20.06.2024
4 minutes de lecture
L’acier au carbone est un matériau de construction très utilisé dans le milieu industriel, en raison du très bon compromis entre son coût et un grand nombre de ses performances. Toutefois, dans certaines applications, il peut se retrouver en contact avec un milieu agressif, comme par exemple un milieu aqueux acidifié par la présence de CO2, ce qui occasionne sa dégradation par corrosion. Afin de mieux comprendre et améliorer la protection des aciers au carbone dans un tel environnement, les équipes Corrosion d’IFPEN, du laboratoire Mateis de l’INSA-Lyon et de l’Institut de Fonctionnalisation des Surfaces (IFS) de l’Université de Leeds se sont associées pour mener des travaux de recherche en commun. Ces travaux ont visé à maîtriser la performance des surfaces « pseudo passives » observées sur ces aciers, en développant des méthodologies de caractérisation pour étudier des mécanismes de protection à l’œuvre.
Tenue à la corrosion, un talon d’Achille pour différents usages liés à la transition écologique
La transition vers une économie décarbonée fait appel à de nouvelles technologies dont certaines, comme le CCUS (capture, transport, utilisation et stockage du CO2) ou la synthèse de biocarburants, mettent en jeu des effluents aqueux contenant du CO2 en solution. Ces milieux peuvent être source de corrosion des équipements employés et particulièrement ceux en acier au carbone. En effet, si l’acier au carbone présente de nombreux avantages tant du fait de son faible coût, de sa disponibilité, de sa recyclabilité que de ses propriétés mécaniques et d’assemblage (mise en forme, soudage), sa résistance à la corrosion reste un point faible. Toutefois, sous certaines conditions, sa surface peut se protéger par la formation d’une couche « pseudo passive ». Cette dernière est une couche d’oxyde ou de carbonate de fer formée en surface et qui peut être éventuellement renforcée par l’incorporation d’autres éléments métalliques.
Evaluation des conditions physico-chimiques à proximité de la surface qui se corrode
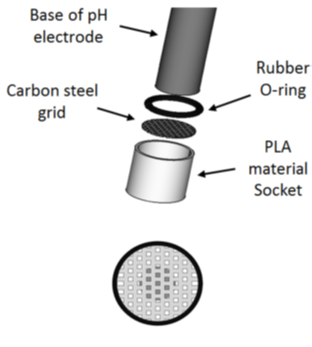
Afin de mieux caractériser l’environnement aqueux dans la zone de corrosion, un montage spécifique (figure 1) a été développé pour évaluer le pH local à proximité d’un échantillon immergé dans un milieu aqueux contenant du CO2 et qui se présente sous forme d’une grille en acier au carbone.
| 
|
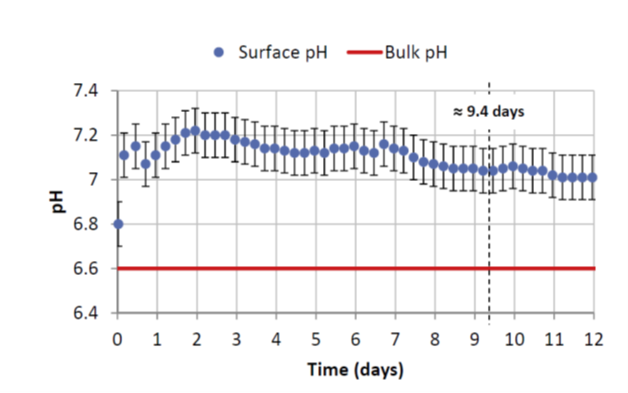
Comme l’indique la figure 2, à l’interface où se produit la corrosion, le pH mesuré est moins acide d’environ 0,4 unité de pH par rapport au pH de la solution loin de l’interface [1]. Cette condition locale est favorable à formation d’une couche pseudo passive.
Mécanismes de protection de la « pseudo passivité » de l’acier au carbone
Des mesures électrochimiques ont confirmé que l’état pseudo-passif est caractérisé par un changement de potentiel d’abandon et une forte diminution de la vitesse de corrosion. C’est ce que l’on observe à la figure 3 avec, au bout de 10 jours, une corrosion devenue si faible (inférieure à 0,02 mm/an) qu’elle permet une utilisation pérenne de l’acier au carbone.
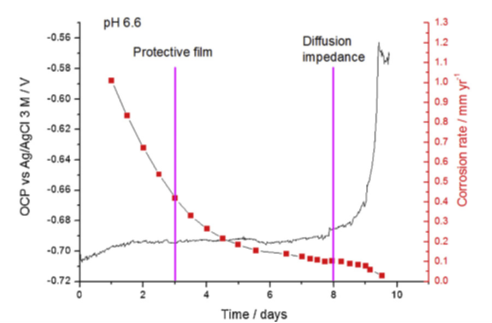
Sur un échantillon exposé à 80 °C et pH 6,6, les analyses de surface ont identifié à certains endroits des traces d’une phase magnétite (Fe3O4), sous un film de carbonate de fer (FeCO3) plus dominant (figure 4). De plus, au fil du temps, la couche de corrosion acquiert une très faible porosité, ce qui se traduit par la constitution d’une « barrière de diffusion ». Ceci est indiqué à la figure 3 par une forte remontée du potentiel en circuit ouvert (OCP), laquelle est considérée comme un indicateur-clé de la protection contre la corrosion [2].

1 Image par électrons rétro-diffusés (Electron Backscatter Diffraction)
Suivi de la corrosion in situ grâce au rayonnement synchrotron
La diffraction des rayons X par rayonnement synchrotron in situ (SR-XRD) a aussi été utilisée pour suivre l'évolution des produits de corrosion sur l'acier au carbone X65 dans un environnement aqueux contenant du CO2 (après exposition à 80 °C, pH 6,3–7,3). Pour cela, une cellule d'écoulement conçue sur mesure a été fabriquée, permettant de suivre en temps réel les changements concomitants du comportement électrochimique et de la croissance du produit de corrosion [3]. Les mesures ont été effectuées à la fois au cours des étapes de « pseudo-passivation » naturelle et dans des conditions de polarisation potentiodynamique2, pour étudier les mécanismes électrochimiques dans les domaines cathodique et anodique (figure 5).
2 C’est-à-dire en faisant varier le potentiel de l’échantillon
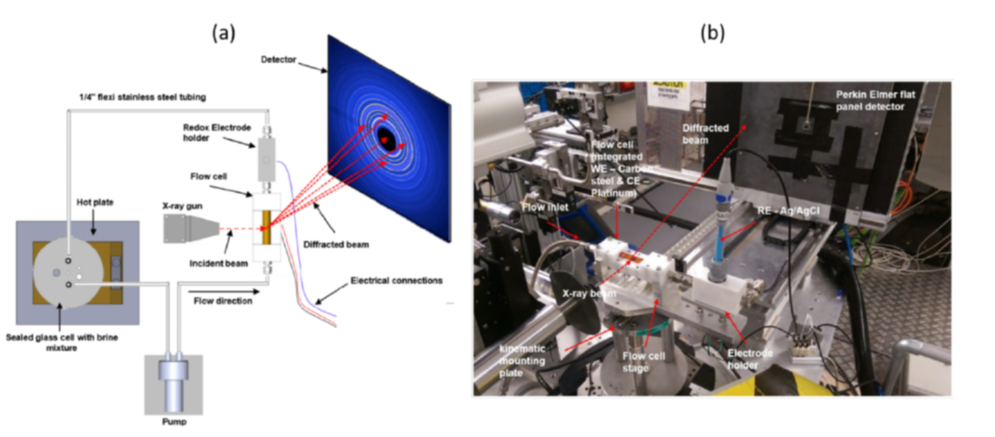
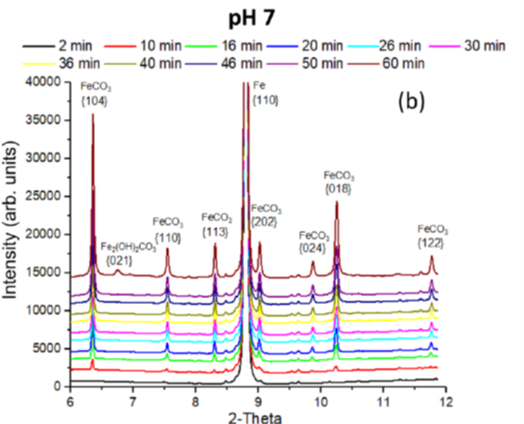
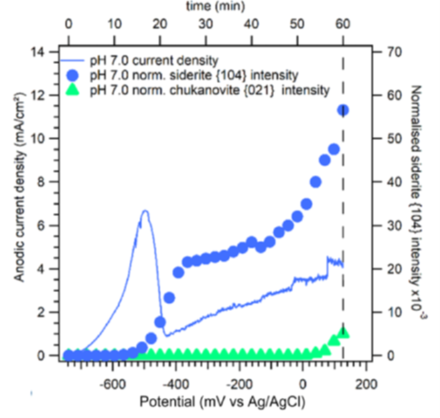
La protectivité (reflétée par un potentiel d’abandon plus noble) que l’on observe lors de la « pseudo-passivation » est fortement liée à l'accumulation de carbonate de fer (FeCO3) à la surface de l'acier (figure 6). La chukanovite Fe2(OH)2CO3 n'a été détectée qu'à des potentiels anodiques élevés (associés à une vitesse de dissolution importante de l’acier), hors du domaine de protection pseudo passif (figure 7) : cette phase semble donc associée à une dissolution active de l’acier au carbone [3].
| 
|
Un travail collaboratif fructueux
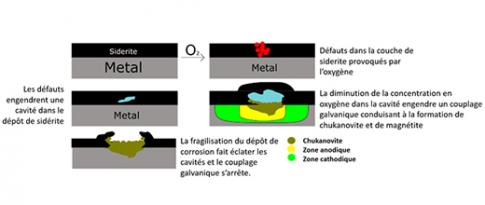
Ce travail de recherche fondamentale collaboratif a permis une meilleure compréhension des mécanismes de protection par « pseudo passivation » de l’acier au carbone en milieu aqueux contenant du dioxyde de carbone. Il démontre aussi l’intérêt des méthodologies mises en place, en particulier l'électrochimie in situ dans un synchrotron. Ces dernières ont également été utilisées pour étudier le renforcement de la protection par incorporation de magnétite dans la couche pseudo passive [4-5] ainsi que l’impact de contaminants, comme l’oxygène, sur la pérennité de la pseudo passivation. [6-7].
Références :
[1] R. de Motte, R. Mingant, J. Kittel, F. Ropital, P. Combrade, S. Necib, V. Deydier, D. Crusset, Near Surface pH Measurements in Aqueous CO2 Corrosion, Electrochemica Acta, 2018, 290, 605-615
>> DOI : https://doi.org/10.1016/j.electacta.2018.09.117
[2] R.de Motte, E. Basilico, R. Mingant , J. Kittel, F. Ropital, P. Combrade, , S. Neicib,, V. Deydier, D. Crusset,, S. Marcelin, A study by electrochemical impedance spectroscopy and surface analysis of corrosion product layers formed during CO2 corrosion of low alloy steel, Corrosion Science, 2020, Volume 172 1 August Article 108666
>> DOI : https://doi.org/10.1016/j.corsci.2020.108666
[3] J. Owen; D. Burkle, E. Basilico, S. Marcelin, F. Ropital; G.R. Joshi; J. Kittel; A. Kleppe, R.C. Woollam, R. Barker, In situ SR-XRD analysis of corrosion product formation during ‘pseudo-passivation’ of carbon steel in CO2-containing aqueous environments, Corrosion Science, 225 (2023) 111598,
>> DOI : https://doi.org/10.1016/j.corsci.2023.111598
[4] J. Owen, R. Barker, F. Ropital, G. R. Joshi, J. Kittel, R. Jacklin, D. Burkle, E. Straume, S. N. Karlsdóttir, Modified magnetite surface layers on carbon steel in aqueous CO2 environments, NACE/AMPP 2023 Conference paper 19127
[5] J. Owen; F. Ropital; G.R. Joshi; J. Kittel; R. Barker, Galvanic effects induced by siderite and cementite surface layers on carbon steel in aqueous CO2 environments, Corrosion Science, 2022-10,
>> DOI : https://doi.org/10.1016/j.corsci.2022.110762
[6] E. Basilico, S. Marcelin, R. Mingant , J. Kittel, M. Fregonese, J. Owens, R. Barker, A. Neville, F. Ropital, Effect of O2 contamination on carbon steel pseudo-passive scales in CO2 aqueous solutions, Corrosion Science, 2022, Vol 205, Article 110388
>> DOI : https://doi.org/10.1016/j.corsci.2022.110388
[7] E. Basilico, S. Marcelin, R. Mingant , J. Kittel, M. Fregonese, F. Ropital, The effect of chemical species on the electrochemical reactions and corrosion product layer of carbon steel in CO2 aqueous environment: A review, Materials and Corrosion, 2021, 1, 16
>> DOI : https://doi.org/10.1002/maco.202012118
Contacts scientifiques : François Ropital, Jean Kittel, gaurav.joshi@ifpen.fr
Les travaux présentés ont été principalement réalisés dans le cadre du travail post doctoral de Rehan de Motte, de la thèse d’Edoardo Basilico et par Joshua Owens (visiteur scientifique de l’Université de Leeds). Nous tenons particulièrement à les en remercier.
Vous serez aussi intéressé par
L’acier au carbone en mode autodéfense contre la corrosion
La corrosion des aciers au carbone ou très faiblement alliés, par les milieux aqueux contenant du CO2, pénalise le développement de nomb
L’Institut de la Corrosion et IFPEN signent un accord-cadre dans le domaine de la transition énergétique
Autoréparation contre la corrosion localisée
Du fait de son faible coût et de ses bonnes propriétés mécaniques, l’acier au carbone est un matériau très utilisé, y compris pour de nombreux équipements en contact avec certains environnements agressifs, comme par exemple les milieux aqueux contenant du CO2...