23.04.2020
3 minutes de lecture
Afin d’améliorer l’efficacité de la dégradation de la biomasse nécessaire à la production de bioéthanol, un travail de thèse IFPEN a dédié ses recherches à l’étude de nouvelles enzymes issues de souches fongiques de type Aspergillus. Il a conclu à l’existence d’une nouvelle famille d’enzymes capable d’augmenter l’activité des cellulases.
Pour un cocktail d’enzymes de Trichoderma reesei plus efficace
La biomasse lignocellulosique est une alternative abondante et renouvelable aux ressources fossiles, mais sa dégradation efficace reste un enjeu majeur pour le développement d’un procédé de bioéthanol à faible coût.
Cette préoccupation a suscité un travail de thèse [1], mené en collaboration avec le laboratoire INRAE « Biodiversité et biotechnologie fongiques » (BBF) à Marseille. Son sujet était focalisé sur la recherche de nouvelles enzymes pouvant augmenter l’efficacité du cocktail d’enzymes de Trichoderma reesei, déjà utilisé dans les procédés de production d’éthanol de deuxième génération pour dégrader la biomasse avant fermentation.
Des enzymes complémentaires dans les souches fongiques d’Aspergillus
Dans un précédent projet ANR (E-TRICEL1), des souches fongiques du genre Aspergillus avaient été identifiées comme possédant des enzymes complémentaires aux cellulases de T. reesei. C’est pourquoi, les travaux en question ont étudié les enzymes sécrétées (« sécrétome ») par cinq souches d’Aspergillus pour leur capacité à améliorer l’activité du cocktail de référence.
Deux des sécrétomes, issus d’une souche d’Aspergillus japonicus, se sont montrés capables d’améliorer significativement l’hydrolyse d’une biomasse d’intérêt, le miscanthus. Ils contenaient une protéine dotée de similarités structurales avec les LPMOs (lytic polysaccharide monooxygenases2), notamment la présence de résidus d’Histidine3 conservés qui typiquement coordonnent un ion Cu2+ (figure).
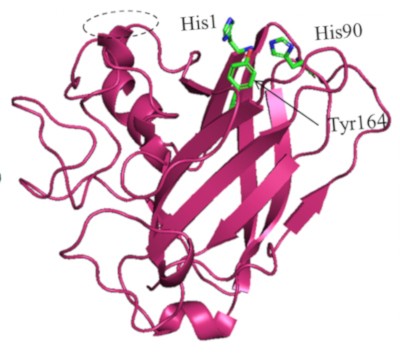
Les acides aminés impliqués dans la coordination du Cu2+, essentiels pour l’activité catalytique, sont schématisés en vert.
Des tests enzymatiques ont ensuite confirmé que cette protéine possédait une activité oxydative et était capable d’améliorer l’activité de la cellulase CBH1 de T. reesei sur des substrats cellulosiques [2].
AA16 : une nouvelle famille à caractériser
Comme ces nouvelles enzymes possèdent une structure différente de celles des LPMOs connus, elles constituent une nouvelle famille dans la base de données CAZy (www.cazy.org) qui classe toutes les enzymes actives sur carbohydrates.
Par la suite, plusieurs autres membres de cette nouvelle famille, nommée AA16, ont montré la même capacité à libérer des sucres oxydés et à augmenter l’activité des cellulases.
Une caractérisation plus approfondie des enzymes AA16 fera l’objet d’un autre travail de doctorat. Il sera notamment question de déterminer l’identité de partenaires redox optimaux ainsi que leur structure tridimensionnelle, par cristallographie, et d’étudier l’activité synergique avec les cellulases sur du substrat lignocellulosique réel.
1 Intitulé Exploration de la biodiversité enzymatique pour la complémentation du secrétome de Trichoderma reesei afin d’améliorer l’hydrolyse des lignocelluloses
2 Enzymes qui clivent les polysaccharides par un mécanisme d’oxydation
3 Acide aminé qui rentre dans la construction des protéines
Références :
[1] Thèse de Camille Filiatrault-Chastel : « Exploration de sécrétomes d’Aspergillus spp. en vue d’une complémentation du cocktail cellulolytique de Trichoderma reesei », 2019.
[2] Filiatrault-Chastel, C., Navarro, D., Haon, M., Grisel, S., Herpoël-Gimbert, I., Chevret, D., Fanuel, M., Henrissat, B., Heiss-Blanquet, S., Margeot, A., and Berrin, J.-G. AA16, a new lytic polysaccharide monooxygenase family identified in fungal secretomes. Biotechnol Biofuels 12, 55 (2019), DOI: 10.1186/s13068-019-1394-y
Contact scientifique : senta.blanquet@ifpen.fr
> En savoir plus sur l'expertise Ethanol et Fermentation d'IFPEN





