07.05.2024
3 minutes de lecture
Les enzymes “Lytiques Polysaccharides MonoOxygénases“ (LPMO) sont des enzymes largement répandues, avec un atome de cuivre dans le site actif, et qui, dans la nature, stimulent la conversion des biopolymères (par exemple la cellulose ou la chitine) [1]. IFPEN et INRAE travaillent depuis plusieurs années d’une part à une meilleure compréhension de ces enzymes [2, 3] et d’autre part sur les cellulases produites par le champignon T. reesei, dans la perspective de leur emploi pour des procédés industriels biosourcés.
Des champignons possédant jusqu'à 60 gènes codant pour des LPMO AA9
Un travail doctoral [4] porté par les deux instituts et avec le soutien du projet ANR SNOEBORD a étudié une sous-famille de LPMO possédant des propriétés atypiques et jusqu’alors inconnues [5]. En effet, certains Polyporales, champignons qui dégradent le bois (pourriture blanche), peuvent posséder jusqu'à 60 gènes1 codant pour des LPMO appartenant à la famille des LPMO AA92. Pourtant, la pertinence fonctionnelle d’une telle redondance reste à découvrir. Des études transcriptomiques comparatives antérieures de six champignons Polyporales cultivés sur des substrats cellulosiques avaient montré la surexpression de nombreux gènes codant pour des AA9, dont certaines détenant un domaine C-terminal3 de fonction inconnue « X282 » (figure 1).
1 Gène dont la traduction conduit à la formation d'une protéine
2 AA9 : Enzymes classées comme ayant une Activité Auxiliaire (AA) de la sous-famille n°9 selon la nomenclature de référence
3 Les enzymes sont des enchaînements acides aminés liés par une liaison peptique. Le premier acide aminé de l’enzyme possède donc une amine libre nommée N-terminal et le dernier une fonction acide carboxylique libre, nommée C-terminal
Une sous-famille de LPMO AA9 se révèle avoir d’étranges affinités avec le phosphate
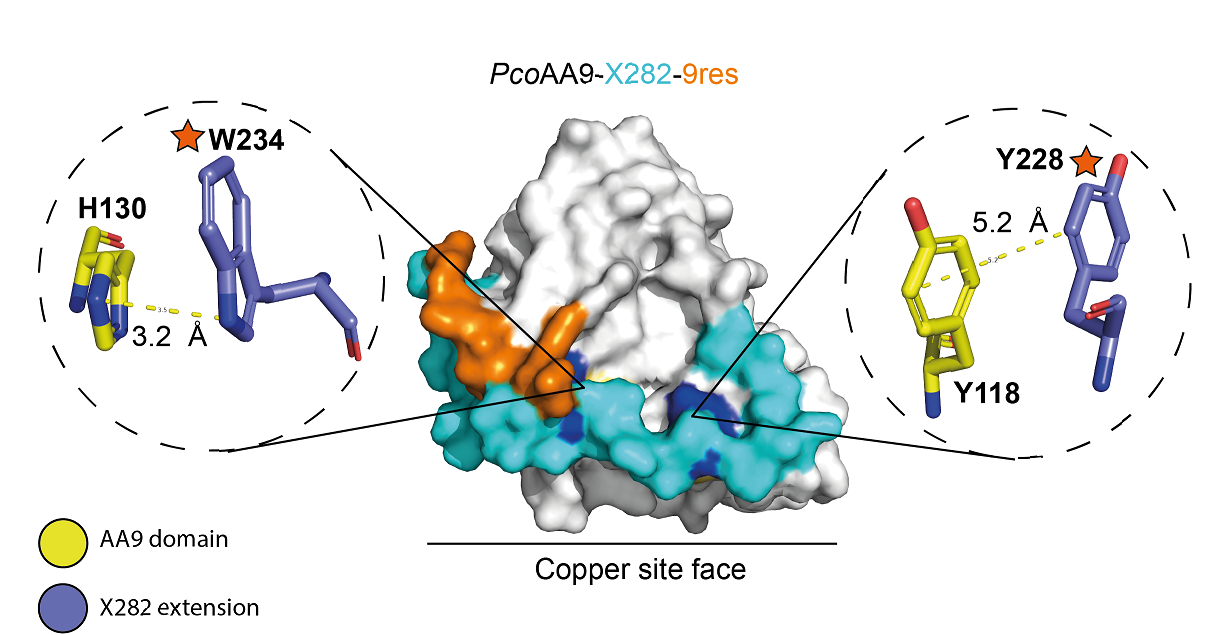
Sur la base des prédictions structurelles et d’analyses phylogénétiques4, nous avons sélectionné et caractérisé six LPMO AA9-X282 avec différents domaines et des caractéristiques atypiques. De manière inattendue, après avoir examiné un large éventail de conditions, ces AA9-X282 n’ont montré que de faibles propriétés de liaison à la cellulose et une activité oxydative cellulolytique faible, voire nulle. L’analyse protéomique a ensuite révélé la présence de multiples résidus phosphorylés à la surface de ces LPMO AA9-X282, y compris un résidu conservé à côté du site de cuivre. Des analyses plus approfondies portant sur une extension C-terminale riche en glycine à 9 résidus ont alors suggéré qu'elle pourrait posséder des propriétés de liaison au phosphate.
4 Une analyse phylogénétique permet de comparer les séquences ADN de gènes issue d’une même famille.
Des enzymes LPMO AA9 qui ont plus d’un tour dans leur sac
Les résultats de ce travail remettent partiellement en question l'implication des enzymes LPMO AA9 dans la dégradation des parois cellulaires végétales et ouvrent de nouvelles pistes pour expliquer la divergence de fonction de certains membres d’enzymes LPMO de la famille des AA9 fongiques.
Références :
[1] Vandhana, T.-M., Reyre, J.-L., Sushmaa, D., Berrin, J.-G., Bissaro, B., Madhuprakash, J., On the expansion of biological functions of lytic polysaccharide monooxygenases. New Phytol. 2022 Mar;233(6):2380-2396. DOI: https://doi.org/10.1111/nph.17921
[2] Thèse de Camille Filiatrault-Chastel : « Exploration de sécrétomes d’Aspergillus spp. en vue d’une complémentation du cocktail cellulolytique de Trichoderma reesei », Paris, Institut agronomique, vétérinaire et forestier de France, 2019.
[3] Filiatrault-Chastel, C., Navarro, D., Haon, M., Grisel, S., Herpoël-Gimbert, I., Chevret, D., Fanuel, M., Henrissat, B., Heiss-Blanquet, S., Margeot, A., and Berrin, J.-G., AA16, a new lytic polysaccharide monooxygenase family identified in fungal secretomes. Biotechnol Biofuels 12, 55 (2019), DOI: https://doi.org/10.1186/s13068-019-1394-y
[4] Thèse de Jean-Lou Reyre : “ Lytic Polysaccharide Monooxygenases (LPMO)" Fongiques : Mise en œuvre en bioraffinerie et découverte de nouvelles enzymes aux propriétés atypiques», Université Paris-Saclay, 2023
[5] Reyre, J.-L., Grisel, S., Haon, M., Xiang, R., Gaillard, J.-C., Armengaud, J., Guallar, V., Margeot, A., Arragain, S., Berrin, J.-G., Bissaro, B. Insights into peculiar fungal LPMO family members holding a short C-terminal sequence reminiscent of phosphate binding motifs. Scientific Reports 13, 11586 (2023), DOI: https://doi.org/10.1038/s41598-023-38617-5
Contact scientifique : Simon Arragain
Vous serez aussi intéressé par
Hydrolyse de la biomasse lignocellulosique : étude des interactions enzyme-substrat (HDR 2015)
Le périmètre de mon HDR a couvert dix années de recherche à IFPEN dans le contexte du développement de Futurol™, procédé destiné à produire du bioéthanol de 2e g
Préparer le changement d’échelle pour des enzymes bien agitées
Extrapoler les technologies de production d’éthanol à partir de biomasse
La production industrielle d’éthanol à partir de biomasse lignocellulosique a été démontrée par le projet Futurol™a.